Agricultura marina sin fertilizantes…
Índice del artículo
- 1 Agricultura marina sin fertilizantes…
- 2 Importancia de las macroalgas
- 3 Características generales de las macroalgas
- 4 Morfología y fisiología general de las macroalgas
- 5 Ciclo de vida de las macroalgas
- 6 Especies más cultivadas de macroalgas
- 7 ¿Cómo se cultivan las macroalgas?
- 8 Manejo poscosecha y almacenamiento de las macroalgas
- 9 Principales enemigos de las macroalgas
- 10 Futuro del rubro de las macroalgas
- 11 Referencias Consultadas
Las macroalgas son algas, principalmente marinas, que pueden verse a simple vista. La mayoría de ellas están clasificadas como bentónicas, es decir que viven sujetas al fondo marino.
Son organismos que realizan fotosíntesis, por lo que son consideradas el equivalente marino de las plantas terrestres.
Las especies de macroalgas en el mundo son muy numerosas y pueden llegar a alcanzar unas doce mil especies. Estas se encuentran distribuidas en los mares costeros de casi todos los continentes.
Algunas especies miden sólo unos pocos milímetros o centímetros de tamaño. Otras más grandes pueden crecer hasta una longitud de 30 a 50 metros.

La acuicultura de macroalgas se ha expandido rápidamente. Además de su empleo en la alimentación humana estos vegetales son utilizados para la extracción de agar, carragenina y alginatos, todos con numerosas aplicaciones en diferentes campos de la industria.
Su cultivo en el mar presenta grandes beneficios ya que en este medio cuentan con la luz solar y los nutrientes necesarios para su desarrollo, por lo que no requieren fertilización.

Cultivo de macroalgas en punto de cosecha al atardecer.
Origen e historia de las macroalgas
Las macroalgas como fertilizantes
Desde épocas remotas las macroalgas eran utilizadas para fertilizar las tierras de labranza en las zonas costeras, permitiendo el aprovechamiento de las que eran arrastradas por las mareas hacia las costas. En algunas islas del Mar del Norte, los arribazones de algas eran utilizadas en combinación con arena y limo para la formación de suelos agrícolas. En el siglo XIV el cultivo de estas especies se practicaba de forma rudimentaria como complemento de la actividad agrícola, principalmente en países asiáticos. El cultivo era realizado generalmente en zonas de amplios intermareales, plantando hileras de rocas sobre las cuales crecían las grandes macroalgas pardas que posteriormente eran recolectadas durante la bajamar. Las especies más empleadas eran del grupo de las Fucales o algas pardas, ricas en potasio, nitrógeno y fósforo.

Fucus, alga marina muy rica en yodo.
Inicios de la actividad industrial
En el siglo XVII en España, fueron descubiertos algunos subproductos de las algas que podían ser utilizados para la fabricación del cristal. Sin embargo, este uso sufrió un declive a partir del siglo XVIII. En el ámbito de Europa se destacó la extracción de sosa y potasa a partir de los géneros Fucus y Ascophyllum. También se obtuvo yodo a partir de algas Laminarias, especies muy ricas en dicho elemento. En 1883 el escocés Edward Stamford logró aislar la algina de las cenizas de algas. Esto originó el desarrollo de la llamada industria de los alginatos, que tuvo su auge durante la I Guerra Mundial en Australia, Tasmania y USA. Paralelo a esto, fueron descubiertas otras propiedades en las algas. Tales como el contenido de carragenina y agar de la especie Chondrus, cuya acción gelificante resultó significativa para la industria farmacéutica y alimentaria.

Chondrus cryspi.
Primeros usos como alimento de las macroalgas

Ensalada de algas.
La utilización de las macroalgas en la alimentación humana tiene sus orígenes en los países orientales, en países como Japón, China y Corea donde constituyó la base de la alimentación popular a partir del siglo XVII. Desde entonces la industria alimentaria se ha ido extendiendo en todo el extremo oriente, principalmente en Japón. Pero ha sido sólo en los últimos 50 años cuando se han establecido las bases científicas para su cultivo. El cultivo tradicional en ambientes marinos o hábitats costeros precisa el fijar las plantas a sustratos naturales y/o artificiales. En la mayoría de los casos se requiere el control y cultivo del ciclo completo del alga. Esta forma de cultivo ha sido ampliamente desarrollada en países asiáticos, con tradición en el consumo directo de estos vegetales y donde la demanda para su uso alimenticio es amplia.
Etimología de la palabra
La palabra alga viene del latín alga. Este término data de la antigüedad y se refiere a lo que los romanos conocían como plantas de mar.
Una fuente de productos naturales para la industria…
Importancia de las macroalgas
En la alimentación

Diversas recetas hechas con macroalgas como ingrediente principal.
- Diversas macroalgas se consumen directamente bien sea recolectadas de la naturaleza o cultivadas como Porphyra, Laminaria y Undaria, principalmente en países asiáticos como China, Japón, Corea y Tailandia.
- Algunas especies pueden utilizarse como aditamento en la confección de salsas, sopas, confituras, macarrones, guisados con carnes e incluso en dulces.
- Además son empleadas, en la elaboración de piensos para la alimentación de especies acuáticas, aves o ganado.
En la salud
- Estos vegetales son la base de muchos productos farmacéuticos empleados en el tratamiento contra el cáncer, nutrición y terapias naturales.
- Son conocidos los efectos beneficiosos de los extractos de algas verdes, rojas y pardas para bajar el colesterol y disminuir la presión sanguínea.
- Los extractos de un buen número de especies presentan actividad antiviral o intervienen en el funcionamiento del sistema nervioso central.
- Los productos derivados (alginatos, carragenina, agar y agarosa) son empleados ampliamente en cosmetología en cremas hidratantes. También para el tratamiento de arrugas, protección solar, tratamiento para el cabello y maquillaje.

La industria cosmética es un destino importante para la producción de algas.
En lo ecológico
Las macroalgas utilizan dióxido de carbono y liberan oxígeno durante la fotosíntesis. Es por ello que juegan un papel fundamental en la composición de la atmósfera que respiramos. Sus nutrientes son usados por las plantas y organismos que las consumen directamente. Posteriormente son retornados al sistema enriqueciendo al ambiente marino. En la zona litoral ayudan a mantener importantes ecosistemas. También sirven de hábitat para la reproducción, reclutamiento y crianza de numerosos peces, mamíferos y aves. 
En la Agricultura
- Las algas se emplean también como fertilizantes agrícolas debido a la gran variedad de nutrientes minerales que contienen sus tejidos.

Las macroalgas pueden ser usadas como abonos verdes en gran cantidad de cultivos gracias al alto contenidos de minerales en sus tejidos.
- Debido a sus coloides, muchas especies sirven como excelentes acondicionadores del suelo, en forma de cenizas o secas.
- Algunas especies de rodofitas acumulan gran cantidad de carbonato de calcio. Estas pueden ser molidas e incorporadas al terreno sirven para corregir suelos turbosos y de mucho humus.
- También pueden ser empleadas como estabilizadores de pH y acondicionadores de suelos.
Otros usos industriales
- En la industria textil se utilizan para imprimir el color en las telas.
- También se usan en el tratamiento del papel, del vidrio y en la elaboración del barniz.
- Algunas grandes algas como las laminarias se pueden utilizar para producir diferentes biocarburantes. Por ejemplo, el bioetanol que se obtiene por fermentación alcohólica de los azúcares contenidos en las algas.

Macrocystis pirifera usada para la extracción de alginatos, en la obtención de biocombustibles y últimamente como alimento humano.
Aportes nutricionales
 Desde el punto de vista nutricional las macroalgas presentan las siguientes características:
Desde el punto de vista nutricional las macroalgas presentan las siguientes características:
- Son bajas en calorías.
- Presentan alta concentración de proteínas.
- Fibra dietética.
- Minerales.
- Vitaminas.
Las diferentes especies muestran variaciones amplias en la composición química que se relaciona con factores ambientales como:
- Las temporadas estacionales.
- Temperatura.
- Luz.
- Salinidad.
- Localización.
- Condiciones de almacenamiento.
La siguiente tabla muestra la composición química de algunas de ellas:
Composición química de algas (g/100 g de base seca)
| Algas | Proteínas | Lípidos | Cenizas | Energía (Kcal) |
| Macrocystis pirifera | 13,2 | 0,7 | 10,8 | 360,3 |
| Ulva lactuca | 27,2 | 0,3 | 11,01 | |
| Laminaria sacharina | 25,70 | 0,79 | 34,78 | |
| Durvillaea antarctica (Cochayuyo) | 10,4 ± 0,6 | 0,8 | 17,9 | 332,4 |
| Hizikia fusiforme | 10,9 | 1,4 | ||
| Gracillariopsis tenuifrom | 20,9 | 0,26 | 4,29 | |
| Kappaphycus alvarezii | 3,87 | 0,29 | 54,31 | |
| Sargassum filipendula | 9,0 | 0,15 | 38,06 | |
| Agarophyton chilensis | 13,3 | 0,4 | 24 | 219,2 |
Proteínas
En general, las proteínas de algas son ricas en los aminoácidos glicina, arginina, alanina, pero limitantes en lisina y cistina.
Lípidos y ácidos grasos
Su contenido de lípidos es bajo (1 a 5% del peso seco). Los lípidos neutros y glicolípidos los más abundantes. La proporción de ácidos grasos esenciales en algas es mayor que en plantas terrestres. Estas sintetizan gran cantidad de ácidos grasos poliinsaturados de la familia de ácidos grasos omega-3. El consumo de estos ácidos grasos se relaciona con disminución del riesgo de padecer enfermedades cardiovasculares, particularmente enfermedad coronaria.
Vitaminas y minerales
Son excelente fuente de vitaminas A, B1, B12, C, D y E, riboflavina, niacina, ácido pantoténico y ácido fólico. El contenido de minerales es muy alto, alcanzando un 36% de peso seco, destacándose elementos como:
- Sodio.
- Calcio.
- Potasio.
- Cloro.
- Sulfuro.
- Fósforo.
Una porción de Ulva lactuca aporta aproximadamente 257 mg de calcio, similar al aporte de queso. Las algas son fuente primaria de yodo, llegando a aportar el requerimiento diario de yodo en el adulto (150 μg/día).
Mercado mundial de las algas marinas
La industria de las algas marinas utiliza entre 7.500 y 8.000 millones de toneladas de algas húmedas al año. Estas se recogen del ambiente natural (bancos naturales) o bien, de cultivos (acuicultura). El comercio mundial de esta industria está dirigido a 5 sectores:
- Alimentos para consumo humano (70%).
- Industria de los ficocoloides o coloides marinos: agar, alginatos, carrageninas (25%).
- La industria de los ficosuplementos.
- Industria cosmética, farmacéutica, nutracéutica y botánica.
- Productos agroecológicos: abonos y fertilizantes orgánicos.
En cuanto a los productos, las algas rojas encabezan la cuota de mercado, seguidas de las marrones y las verdes. 
Características generales de las macroalgas

Clasificación taxonómica
Las macroalgas son organismos eucariotas, formados por células con núcleo verdadero por lo que se incluyen dentro del Reino Protistas. Constituyen un conjunto polifilético, ya que sus miembros provienen de varios orígenes taxonómicos, pero presentan caracteres morfológicos y anatómicos semejantes. Para su ordenación en filos y clases se han utilizado características como:
- La composición de los pigmentos.
- Las sustancias de reserva.
- La pared celular.
- Las características de la división celular.
En grandes rasgos, se clasifican en tres grandes Divisiones:
- División Chlorophyta (Algas verdes): suman unas 6.000 y 7.000 especies.
- La división Phaeophyta (Algas pardas): son las de mayor tamaño y es posible encontrar alrededor de 1500 especies.
- Y la división Rhodophyta (Algas rojas): con más de 3.000 especies.

Alga verde: Monostroma sp.

En la foto talo de alga roja: Callophyllis sp.

Alga parda: Lessonia nigrescens.
La mayoría de las algas de los océanos cálidos son algas rojas que absorben la luz azul penetrante profunda por lo que pueden existir en profundidades mayores que otras especies de algas. Las pardas incluyen aquellas que se encuentran en las costas de las zonas templadas y los grandes lechos de kelps en alta mar. Hay pocas macroalgas verdes, y la mayoría son de aguas tropicales.
Morfología y fisiología general de las macroalgas

Las algas rojas junto con las pardas son las que habitan a mayores profundidades.
Un mundo de formas y colores…
Existe una gran variedad de macro algas, algunas de las cuales generalmente las más grandes tienen estructuras complejas con tejidos especiales, mientras otras están formadas por células que son prácticamente idénticas. Las células de las algas también vienen en diferentes tamaños, muchas especies pueden medir un centímetro o más. Adicionalmente contienen varios núcleos y orgánulos celulares para mantener la función de la célula y el rápido crecimiento de las algas en su conjunto.
Organización celular
La organización celular de estos organismos, es de tipo eucarióntica. Se caracterizan por presentar las siguientes características:
- Núcleo delimitado por una doble membrana.
- Mitocondrias.
- Cloroplastos.
- Retículo endoplásmico.
- Complejo de Golgi.
- Lisosomas.

Esquema representativo de una célula algal.
Pared celular
La mayoría presentan una pared celular conformada principalmente de celulosa y glicoproteínas. Otros componentes de relevancia son los polisacáridos con gran importancia en la industria como alginatos, agares y carrageninas.
Cloroplastos
Los caracteres ultra-estructurales de los cloroplastos han sido empleados para la separación de las divisiones de algas. Entre estos caracteres tenemos:
Número de membranas
Algunos grupos presentan la típica doble membrana, otros presentan tres o cuatro. Generalmente la última membrana continúa con el retículo endoplásmico.
Numero de tilacoides
Ente los cloroplastos algunos presentan tilacoides aislados o en bandas apiladas de 2, 4 ó 6, denominado este arreglo como grana.
Arreglo de los tilacoides
En las algas rojas se agrupan uno o dos tilacoides paralelos a la membrana interna del cloroplasto.
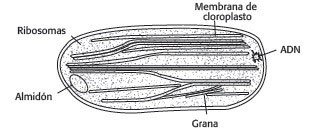
Esquema general de un cloroplasto con tilacoides apilados (grana).
Organización vegetativa
El cuerpo vegetativo de las macroalgas se denomina talo. Este presenta algunas estructuras características como:
El rizoide
Es una estructura equivalente a la raíz ubicada en la base del alga sirviendo para fijarse al sustrato. Puede ser muy ramificado o tener forma de disco o bulbo.
El estipe
Esta estructura corta equivalente al tallo crece en la base del alga. Esto ocurre en especies como la Laminaria. También es posible que crezca hasta convertirse en una gran estructura como en Sargassum o Macrocystis.
Las láminas
Son las partes planas de las algas equivalentes a las hojas. Al conjunto de estipe y láminas se le denomina fronda. 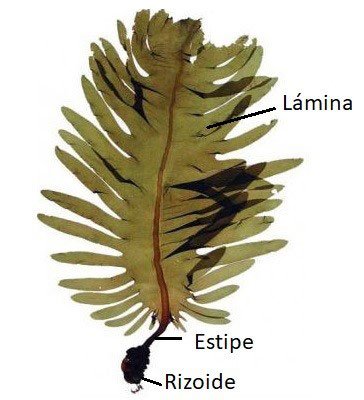
Pigmentos fotosintéticos
La clorofila a es el pigmento fotosintético (por excelencia) común en todas las algas. Sin embargo, pueden presentar también clorofila b y c. Así como pigmentos accesorios responsables de la coloración externa que presentan las algas. Los pigmentos accesorios más comunes son:
- Las ficobilinas (ficocianinas y ficoeritrinas, solubles en agua) presentes sólo en algas verde azules y algas rojas.
- Fucoxantinas.
- Xantofilas.
- Carotenos.
Sustancias de reserva

- Almidón.
- Crisolaminarina.
- Laminarina.
- Manitol.
- Paramilion.
Estas sustancias forman gránulos que se encuentran dispersos en el citoplasma celular, en los cloroplastos o en los pirenoides.
Nutrición
Aunque no está clasificada como una planta, las algas tienen los mismos requisitos de crecimiento que sus semejantes que viven en la tierra: luz, agua y nutrición.
Su principal vía de nutrición es la fotosíntesis. Mediante esta convierten la luz solar en energía química que se transforma en glucosa y azúcar.
La glucosa es el bloque de construcción para los carbohidratos. Siendo una fuente de energía para la producción de otras sustancias orgánicas necesarias para crecer y llevar a cabo procesos vitales.
Las algas absorben lo que necesitan directamente del agua a través de los tejidos superficiales. Por esta razón el agua alrededor de ellas debe moverse continuamente. Este proceso trae nuevos suministros de gases como el dióxido de carbono y nutrientes como nitrógeno, fósforo y minerales.
Crecimiento de las macroalgas
Las macroalgas presentan un crecimiento por medio de células meristemáticas. Estas células se caracterizan por crecer y multiplicarse formando otros tejidos adultos diferenciados.
Esta función puede ser desempeñada por una sola célula que puede ser:
- Apical.
- Intercalar o marginal.
- Conjunto de células: formando la llamada región meristemática apical o margen de células.
El crecimiento de las algas se puede dividir en:
Crecimiento apical
Cada filamento o rama del talo crece por la acción de una única célula apical. Esto da origen a las siguientes divisiones:
- Transversales: originando los segmentos del eje central.
- Longitudinales u oblicuos: dando lugar a los filamentos o ramas laterales. Esto ocurre para varios tipos de algas pardas como Fucus vesiculosus.

Crecimiento intercalado difuso
Ocurre cuando la mayoría de las células del talo son capaces de dividirse, no hay diferencia entre células meristemáticas y vegetativas. La forma del talo suele ser bastante irregular, como por ejemplo en Ulva sp.

Crecimiento marginal
El talo crece por divisiones de las células del borde, principalmente en un plano trasversal. De esta forma se genera una morfología laminar con tendencia a ensancharse en los ápices. Ej. Padina pavonica.

Crecimiento tricotálico
Este tipo de crecimiento se caracteriza por la aparición de una franja de filamentos en los extremos del talo. Las células basales de dichos filamentos son las responsables de dicho crecimiento. Puede ser apical-tricotálico o marginal-tricotálico Ej. Sporochnus sp.
Las algas pardas más grandes pueden crecer hasta medio metro por día ¡Eso equivale a un par de centímetros por hora!
Reproducción en macroalgas
Las algas se reproducen por vía asexual y sexual. Ambos procesos pueden ser empleados alternativamente dependiendo de las condiciones del medio o de su ciclo vital.
Reproducción asexual
Puede ser por simple división celular o por fragmentación del talo de las macroalgas. Cada uno de los fragmentos que proceden del organismo parental desencadena un nuevo individuo.
Muchas algas producen igualmente células especiales llamadas esporas. Estas originan un nuevo talo directamente.
Los talos que producen esporas se llaman esporofitos.La formación de estas esporas se realiza en los esporangios mediante mitosis (mitosporas) o mediante meiosis (meiosporas).
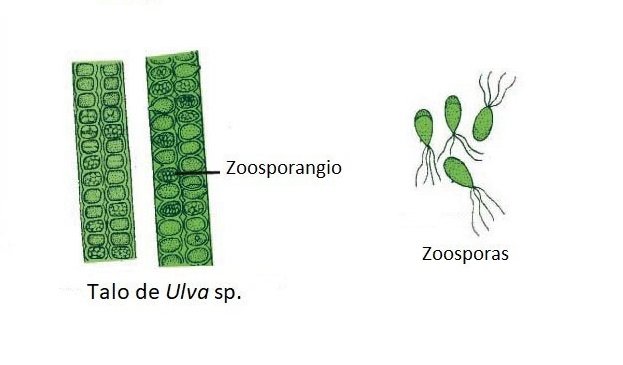
Si estas esporas se desplazan a través de flagelos se llaman zoosporas (Ej. Ulva lactuca).
Una vez liberadas las zoosporas, nadan durante una hora aproximadamente. Luego descansan sobre algún sustrato, pierde sus flagelos y secreta una pared a su alrededor.
Poco después, se divide por una pared transversal que da lugar a dos células. La célula inferior se desarrolla en un rizoide o estipe y la superior en la lámina o talo.
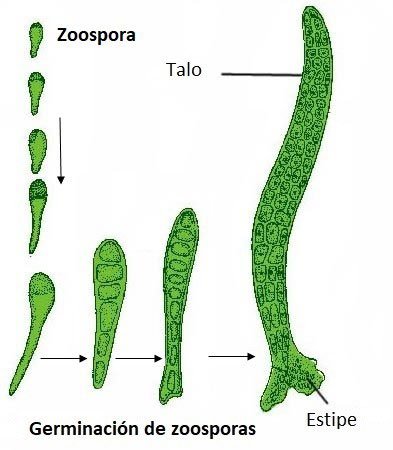
Reproducción asexual en Ulva.
Reproducción sexual
La reproducción sexual implica la recombinación genética y con ella, el aumento de la variabilidad genética en una población a través del proceso de meiosis.
En este proceso ocurre fusión de dos células reproductivas haploides (gametos masculino y femenino), para dar lugar a un zigoto diploide (2n).
Posteriormente en el ciclo del alga ocurre la meiosis. Los cromosomas aportados por cada uno de los gametos se aparean y recombinan para luego separarse. Así se originan nuevas células haploides (n).
Entre las algas con este tipo de reproducción sexual tenemos Porphyra, Monostroma, Laminaria, Undaria o Gracilaria.
Alternancia de generaciones
Muchas algas, como las verdes del género Ulva, tienen alternancia de generaciones. Se producen dos concepciones, una que se reproduce sexualmente y otra que se reproduce asexualmente.
La forma haploide, llamada gametofito, origina a través de mitosis gametos haploides. Estos gametos se unen y forman un cigoto diploide, que se desarrolla en un organismo denominado esporofito.
El esporofito produce a través de meiosis esporas haploides que se desarrollan y forman el gametofito.
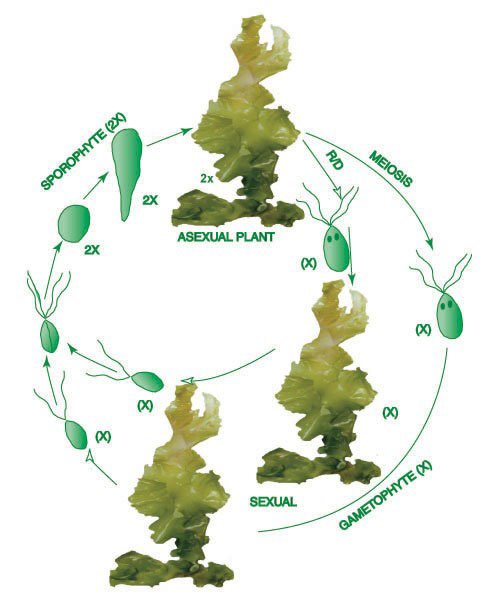
Ciclo de vida de las macroalgas
De acuerdo al sitio donde ocurre la meiosis se diferencian tres tipos de ciclo de vida en las algas denominados:
- Cigótico: la meiosis ocurre durante la germinación del cigoto (común en algas unicelulares.
- Gamético: la meiosis origina gametos.
- Espórogenica: la meiosis ocurre en el esporofito para producir esporas.
Dependiendo del número de fases adultas de vida libre que participen en el ciclo de vida pueden clasificarse como:
- Monogenético: una sola fase.
- Digenético: dos fases.
- Trigenético: tres fases de vida libre.
La carga genética que presentan las fases adultas también juegan un papel en la nomenclatura de los ciclos de vida. Estos pueden ser haploide (n) o diploide (2n).
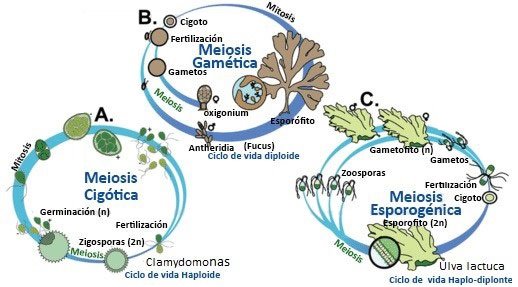
Esquemas de los ciclos de vida. A.) Ciclo de vida cigótico (una fase adulta n), B) El ciclo de vida gamético (una fase adulta 2n), c) Ciclo de vida espórico o alternancia de generaciones (dos fases adultas, gametofito n y esporofito 2n).
Hábitat
Básicamente las algas se encuentran en todos los mares costeros tanto de aguas frías como tropicales.

Salvo algunas especies que viven totalmente en flotación, como el alga café Sargassum, el resto requiere pegarse a rocas, corales o fondos arenosos. Generalmente a relativamente poca profundidad donde todavía llegue suficiente radiación solar.
Las macroalgas rojas normalmente crecen a las mayores profundidades típicamente hasta 30 metros hacia abajo. Las verdes prosperan en aguas poco profundas y las algas pardas en el medio.
En aguas excepcionalmente claras se pueden encontrar algas que crecen hasta 250 metros debajo de la superficie del mar.
Se ha hecho referencia a un alga roja calcárea que se encontró a una profundidad de 268 metros, donde solo penetra el 0,0005 por ciento de la luz solar.
Las especies que viven en estas aguas deben contener pigmentos que absorban la luz azul y violeta. Como consecuencia parecen tener el color rojo complementario.
Sin embargo, esta relación no siempre es cierta. Las algas que viven en la superficie del océano contienen pigmentos que las protegen de la luz ultravioleta del sol.

Kelps.
Características generales de las diferentes macroalgas
| Tipo de alga | Composición de pared celular | Sustancias de reserva | Pigmentos | Tipo de reproducción | Ejemplos |
| Algas verdes | Celulosa, xiloma o manosa | Almidón | Clorofila a y b, xantofilas | Reproducción vegetativa, espórica y gamética | Aguas tropicales:Ulva spp. Codium spp. Monostroma. Chaetomorpha. |
| Algas pardas | Celulosa y polisacáridos como ácido algínico y fucoidina, | Polisacáridos del tipo laminarina y manitol, compuestos fenolicos | Clorofila a y c y xantofilas | Reproducción sexual (gamética) y asexual (vegetativa y espórica) | Aguas frías: Saccharina japonica.Undaria pinnatífida. Lessonia spp. Sargassum spp. Aguas tropicales: Dictyota. Laminaria. Macrocystis. Padina |
| Algas rojas | Celulosa y polisacáridos de galactanos, como el agar o carragenano | Almidón de las florideas | Ficoeritrina, ficobilina, clorofilas a y d | Reproducción vegetativa, espórica y gamética | Aguas frías:Chondrus crispus. Aguas tropicales: Eucheuma. Gracilaria. Gelidium. Gracilariopsis. Porphyra. |
Especies más cultivadas de macroalgas
Alrededor de 10 especies de macroalgas son cultivadas intensivamente con fines comerciales:
- Pardas: Laminaria japónica, Undaria pinnatifida, Sargassum fusiforme.
- Rojas: Porphyra spp (nori japonés), Eucheuma spp., Kappaphycus alvarezii y Gracilaria spp.
- Verdes: Enteromorpha clathrata, Monostroma nitidum, Caulerpa spp. y Ulva.
Las especies Undaria pinnatifida (wakame japonés) y Sargassun fusiforme, así como las algas verdes Ulva, Enteromorpha, Monostroma, Caulerpa son importantes fuentes de alimento en Asia. Mientras que las algas rojas, tales como Gracilaria son importantes principalmente para la extracción de agar. Por otra parte Eucheuma y Kappaphycus para la extracción de carragenina usado en cosméticos, alimentos procesados y uso industrial.

Especie Gracilaria.

En la foto la especie Eucheuma.

Especie Kappaphycus alvarezii.
Producción mundial de algas por acuicultura
El cultivo de macroalgas representa un 24 % de la acuicultura marina mundial, estando concentrada principalmente en China, Corea y Japón. La producción mundial de plantas acuáticas cultivadas, en la que predominan considerablemente las algas marinas, aumentó su volumen de 13,4 millones de toneladas en 2005 a algo más de 30 millones de toneladas en 2016. Sólo pocas especies de macroalgas contribuyen con los datos de producción por acuicultura. El alga roja Eucheuma contribuyó con un 35 % de la producción global, mientras que el kelps japonés clasificado como Laminaria japónica contribuye con el 27 %. Luego le siguen en orden de importancia Gracilaria spp., Undaria pinnatifida, Kappaphycus alvarezii y Porphyra spp. (Nori japonés).
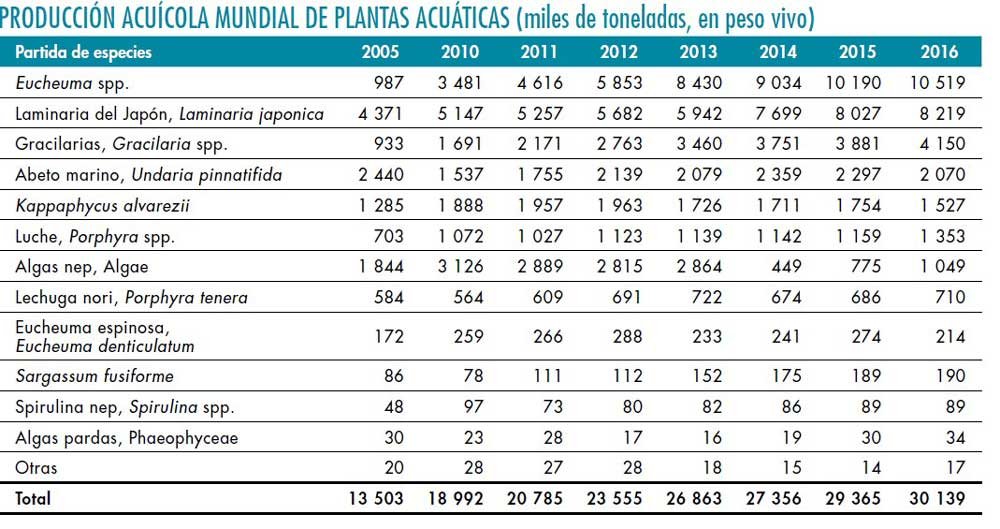
Fuente: SOFI, 2018.
Principales países productores de macroalgas
Los principales países productores de especies cultivadas fueron China, Indonesia, Filipinas y República de Corea (principalmente de Eucheuma, Laminaria japonica, Gracilaria y Undaria pinnatifida). Latinoamérica contribuyó con solo 1,2 % de la producción mundial en el año 2016 (373.000 toneladas), siendo Chile el principal productor con un 95 % de la producción total (15.000 toneladas), seguido por Brasil (4,68%), México (1,15%), Ecuador (0,03%) y Perú (0,01%). El cultivo de macroalgas en Latinoamérica ha estado centrado especialmente en las siguientes especies:
- Algas rojas: Gracilaria chilensis (actualmente Agarophyton chilensis), y las exóticas Kappaphycus y Eucheuma.
- Las algas pardas: Macrocystis pirifera (principalmente para la extracción de alginatos), y Lessonia en Chile y Eisenia arbórea en México.
- Y las algas verdes: Monostroma en Brasil, Ulva en México y Brasil.
Además, se han realizado algunas experiencias de cultivo en Cuba, Venezuela y Colombia, con resultados favorables principalmente con K. alvarezii y Macrocystis pirifera.

Especie Lessonia.

En la foto la especie Monostroma greivillei.

Especie Macrocystis pirifera.
¿Cómo se cultivan las macroalgas?

Tipos de cultivo
El cultivo de macroalgas puede realizarse directamente en el mar o puede ser mixto. Unas fases en un laboratorio de producción complementadas en el mar o en un centro de producción tierra adentro.
Cultivo directo en el mar
Solo puede llevarse a cabo en especies que se desarrollan mediante propagación vegetativa. Mediante una fragmentación manual o mecánica del talo y una resiembra de los fragmentos.
Cultivo mixto mar-centro de cultivo
El desarrollo y recolección se realiza en el mar, pero la semilla y la siembra de esta se hace en el laboratorio. Este cultivo necesita de mano de obra numerosa y calificada.
Cultivo tierra adentro
Se realiza completamente en instalaciones en tierra. Permitiendo el control de las variables ambientales, pero requiere mucha mano de obra calificada e inversión. La escogencia de uno o de otro dependerá de la especie cultivada y de los recursos disponibles para el cultivo.

Cultivo de macroalgas en tanques en el exterior.
Requerimientos del laboratorio de cultivo de macroalgas
Agua de mar
El agua de mar constituye el medio donde se desarrollarán los estados de vida temprano y juvenil de las algas. Por lo tanto se requiere que la calidad de ésta sea óptima. La presencia de contaminación biológica (bacterias, hongos o protozoos) o contaminación química en el agua de mar influirá grandemente en el desarrollo del cultivo. Es preciso aplicar un tratamiento al agua afluente para mejorar su calidad. Una vez bombeada el agua se debe someter a un primer tratamiento de filtración mecánica. Para ello debe emplearse mangas con aberturas de 100, 50, 25 y 10 μm. Posteriormente el agua se filtra a 1 y 0,45 micras con filtro de cartuchos. Finalmente se expone a radiación de luz ultravioleta (UV).

Batería de filtros de cartucho y UV para el tratamiento del agua.
Esterilización
Una vez filtrada el agua de mar debe esterilizarse especialmente para iniciar el cultivo. Si bien no es necesario tener cultivos axénicos (“puros”) para cultivar algas marinas, las fases microscópica y juvenil son sensibles a la contaminación.

Esterilización en autoclave.
Hay una gran cantidad de microorganismos que pueden alimentarse, competir o crecer sobre las macroalgas, incluyendo otras algas, hongos, bacterias, cianobacterias, zooplancton y protozoarios. Hay algunos métodos disponibles para esterilizar el agua de mar, pero el método más efectivo es mediante autoclave, que garantiza la esterilidad a través de un tratamiento que aplica calor y presión extremos al agua de mar.
Medios nutritivos
Si bien el agua de mar natural contiene muchos de los oligoelementos necesarios para el cultivo de algas, la calidad y la cantidad de nutrientes pueden ser variables e insuficientes para el cultivo. El agua de mar natural y artificial debe enriquecerse con una solución nutritiva concentrada, después de que el agua haya sido suficientemente esterilizada. Existen diferentes tipos de medios de cultivo para el desarrollo y crecimiento de los estados tempranos de las macroalgas:
- Medio Provasoli: empleado principalmente en el cultivo de algas pardas.
- Medio de Von Stosch: para algas rojas.
Su función es aportar los macronutrientes esenciales (nitrógeno, fósforo, calcio, potasio, sodio, etc.) y oligoelementos (hierro, manganeso, zinc, cobre, cobalto, zinc, etc.), necesarios para el desarrollo algal. Para las etapas más avanzadas de cultivo en tanques puede emplearse abono foliar comercial.
Temperatura

Iluminación
Las algas marinas son organismos fotosintéticos que incorporan materiales inorgánicos en la biomasa orgánica utilizando energía del sol. En el laboratorio las bombillas fluorescentes proporcionarán suficiente energía luminosa para el cultivo de las plantas. 
Fotoperíodo
Se refiere al período alterno de luz y oscuridad, lo cual es muy importante para el desarrollo normal y el crecimiento de las algas marinas. Un fotoperíodo neutral que se usa comúnmente en el laboratorio es 12 horas de luz seguido de 12 horas de oscuridad (12:12, L: O). Este puede variar según el tipo de alga cultivada. Para controlar el fotoperíodo las luces deben estar conectadas a un temporizador.
Infraestructura
Cuando se busca la obtención de semillas de algas en el laboratorio, es necesario contar con instalaciones básicas como son:
Cuarto de Siembra
Cabina dentro del laboratorio en donde se genera la inoculación de las algas para la creación de cepas. 
Sala de cultivo indoor
Debe estar dispuesta con ventanas de cristal para la mejor captación lumínica y superficies lavables. Utilizada para el mantenimiento de cepas, crecimiento de cultivos en pequeños y medianos volúmenes.
Tanques de cultivo exterior

Etapas del cultivo
Para la obtención del ciclo completo del alga en cultivo se deben desarrollar cuatro etapas fundamentales:
- Obtención de semillas.
- Producción de plántulas.
- Cultivo en Hatchery.
- Cultivo para crecimiento o engorde.
El desarrollo de cada una de estas etapas puede variar dependiendo de la biología de la especie de macroalga a cultivar. La siguiente descripción está basada en el cultivo empleado generalmente en algas pardas.
Obtención de semillas

Captación natural
Se utilizan ramajes secos entrelazados clavados al fondo. Estos emergen hasta el nivel medio de las mareas en zonas de poblaciones algales maduras. Las esporas flotantes liberadas por los ejemplares maduros se adhieren al sustrato y comienzan a germinar. En ese momento son recolectadas y trasladados a zonas acuáticas más ricas en elementos nutritivos para su crecimiento.
Producción de semillas en laboratorio
Se utiliza material reproductivo proveniente del medio natural para inducir la liberación de esporas en el laboratorio. Dando origen a la formación de esporofitos juveniles.
Colecta del material reproductivo maduro
Para iniciar el proceso de cultivo se debe recolectar esporofilas fértiles de macroalgas desde una población costera, donde las esporofilas están totalmente maduras. Las frondas reproductivas son fácilmente distinguibles. Sobre la superficie de la hoja aparecen sectores de mayor pigmentación, que representan las zonas de concentración de esporas o “soros”. Una vez colectadas las esporofilas serán transportadas al laboratorio en bolsas plásticas dentro de recipientes térmicos, en la oscuridad y a bajas temperaturas (< 10°C). 
- Lavar las frondas copiosamente con agua dulce para eliminar los epifitos (diatomeas bentónicas, protozoos, Copépodos) adheridos sobre su superficie.
- Enjuagar las frondas lavadas dos o tres veces con agua de mar estéril filtrada a 0,45 μm.
- Secar sobre un trozo de papel absorbente por un tiempo de 12 horas en oscuridad.
- Cortar los trozos de frondas con un bisturí o tijera en pequeños fragmentos de 2 por 2 cm.
- Depositar los fragmentos en una cubeta con agua de mar estéril y enriquecida con medio nutritivo.

Liberación de esporas
La liberación de esporas ocurrirá después de la re-hidratación de las frondas. Se evidencia por la aparición de coloración amarillo-verdoso en el agua. Además, se puede observar una muestra del agua en el microscopio para comprobar la presencia de zoosporas flageladas. Estas poseen movimiento hasta unas 24 a 48 horas. Una vez que ha ocurrido una suficiente liberación de zoosporas se procede a retirar los fragmentos de frondas del recipiente, conservando así solamente las zoosporas. La suspensión de zoosporas colectadas se vierte en volúmenes conocidos en bolsas plásticas estériles. 
Producción de plántulas
Esta etapa puede realizarse mediante el pre-cultivo en cuerdas o pre-cultivo en suspensión.
Pre-cultivo en cuerdas
En esta modalidad se utiliza cabo de material sintético (ej. polipropileno) de 3 mm de diámetro como sustrato de fijación. El cabo se enrolla ordenadamente sobre un bastidor construido con tubería de PVC. Se sumerge en un recipiente (cubeta) con agua de mar fresca, estéril y enriquecida con medio nutritivo. 
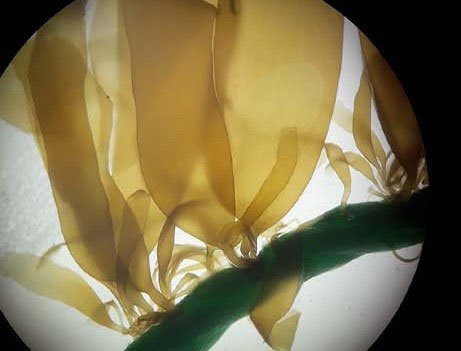
Esporofitos juveniles adheridos a las cuerdas (vistos a través de la lupa).
Después de este lapso se realiza la renovación de agua de mar fresca, estéril y enriquecida cada 7 días. Hasta el momento de ser trasplantado al medio exterior.
Pre-cultivo en suspensión
En esta modalidad conocida, como free-floating, las zoosporas colectadas se mantienen en las bolsas plásticas por un periodo de 7 a 10 días. Se espera que germinen y los gametofitos se fijen a las paredes de la bolsa plástica.
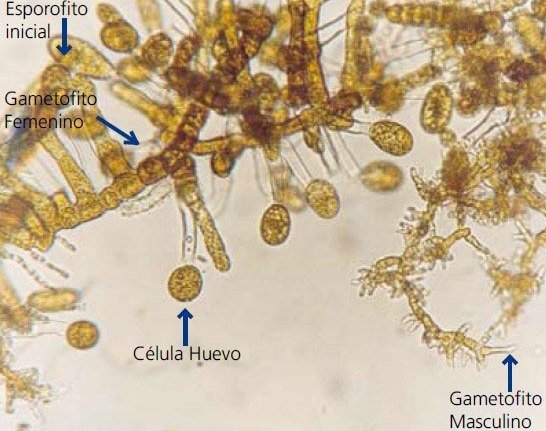
Segmento algal visto al microscopio con diferentes fases reproductivas.
Transcurridos los primeros 10 días se vacía el agua de cada bolsa. Luego se desprenden los gametofitos recién germinados que se han fijado a la pared de la bolsa. En esta fase inicial los gametofitos deberían haberse desarrollado y diferenciado en gametofitos masculinos y femeninos. Si se desea se podrían efectuar cruzamientos de gametofitos de diferente procedencia.
Mantenimiento de los gametofitos
Los gametofitos recolectados se transfieren mediante pipeteo a otra bolsa nueva conteniendo agua de mar fresca, estéril y enriquecida con medio nutritivo. El sistema se mantiene realizando renovación de agua y nutrientes cada 7 días hasta comprobar la presencia de esporofitos tempranos. Deben tener aproximadamente 300 micras de longitud lo cual puede verificarse bajo un microscopio.
Manejo de los esporofitos
Una vez asegurada la presencia de esporofitos, el cultivo se transfiere a matraces o botellas de 2 litros dotadas de agitación constante mediante inyección de aire. 
- Fotoperiodo: 16: 8.
- Temperatura: 15-17 º C.
- Iluminación: 1800 – 2000 lux.
De acuerdo al crecimiento que experimenten los esporofitos y del incremento en densidad se escalará el cultivo. Manteniendo las condiciones ambientales del paso anterior a volúmenes mayores de 5 a 20 litros. 
Cultivo en hatchery
En esta etapa los esporofitos adheridos a los cabos de los bastidores se mantienen en estanques de 1000 litros. Las condiciones de cultivo de la etapa de hatchery para plántulas corresponde a:
- 12:12 h (luz: oscuridad).
- 10 – 12°C en el caso de Macrocystis pirifera.
Las plántulas son trasladadas al mar:
- Cuando alcanzan un tamaño superior a los 8 cm.
- El disco de fijación ya se ha adherido a la cuerda.
Si las plántulas son obtenidas con la técnica de free-floating son trasladadas a estanques de 800 litros, donde permanecen por alrededor de 30 días. 
Encordado de esporofitos jóvenes
Consiste en colocar una a una las plántulas en el entramado de una cuerda. Para ello se utilizan cuerdas de 3 o 4 mm de diámetro, a la densidad deseada (alrededor de 10 esporofitos por metro) para posteriormente llevarlas al mar.

Encordado de esporofitos juveniles.
Esta técnica permite controlar la densidad en las cuerdas de siembra. Disminuyendo así la alta variabilidad de crecimiento observada en cultivos provenientes de inoculación directa con esporas.
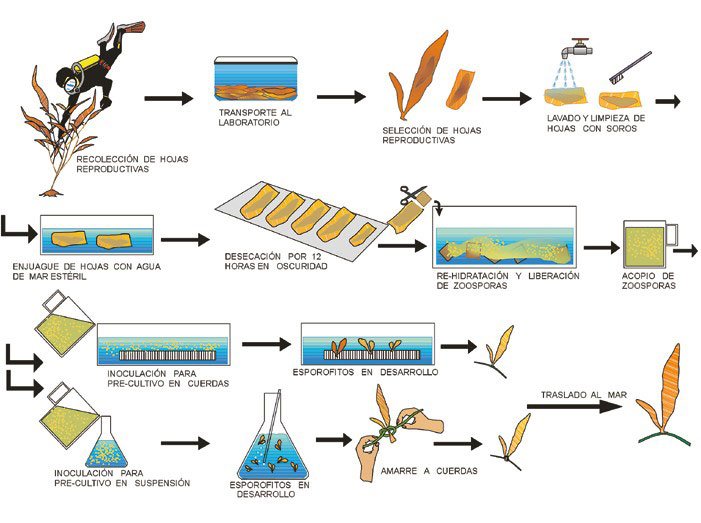
Resumen esquemático del procedimiento de producción de macroalgas pardas en laboratorio (Fuente: Avila et al. 2010).
Manejo del cultivo en laboratorio
El régimen de crianza durante la etapa de laboratorio y precultivo involucra:
- Control de la intensidad de la luz.
- Ajuste de la periodicidad de la luz por medio de cortinas blancas y negras en el techo.
- Control de la temperatura del agua, según la especie a cultivar.
- Fertilización con productos químicos, normalmente nitrato y fosfato para el desarrollo metabólico del alga.
- Remoción de algas comensales.
- Renovar el agua manteniendo una tasa de bombeo adecuada a las necesidades de la población a cultivar.
Cultivo para crecimiento o engorde
Esta etapa comprende desde el traslado de plántulas encordadas o inoculadas hasta la cosecha. Puede ser realizado mediante dos métodos:
- Cultivo en tierra (método intensivo).
- Y el cultivo en el mar abierto (método extensivo).

Cultivo en tierra
Se realiza comúnmente en tanques de diversos tipos y materiales:
- De obra.
- Ladrillos.
- Hormigón.
- Bloques.
- Cemento.
- Prefabricados.
- Fibra de vidrio.
- Metal.
- Instalaciones cercanas al mar.
Las formas de los tanques son rectangulares o circulares. Pueden colocarse en serie o en paralelo, según las características de la zona y de las especies. 
Flujo de agua
En un cultivo intensivo se debe mantener un flujo de agua igual o mayor de 25 litros por metro cuadrado por hora en los tanques. Además, debe garantizarse la exposición periódica a la luz y suministrar agitación del agua. Con esto se previene la estratificación térmica que favorece el intercambio de gases y nutrientes. Eliminando así gradientes de pH, temperatura y concentración de nutrientes. La agitación se logra utilizando aireadores mediante tuberías localizadas en el fondo del tanque generando una circulación adecuada del agua. Permitiendo la exposición periódica de las plantas a la luz en la superficie.
Nutrientes
Además del carbono inorgánico es necesaria la adición de nitrógeno y fósforo. Elementos más importantes como macronutrientes esenciales para satisfacer los requerimientos fisiológicos de las algas. También se han utilizado aguas oceánicas de hasta 60 m de profundidad ricas en nutrientes. Aunque los costos asociados a su bombeo hasta la superficie los hacen sumamente restrictivos. Otra alternativa es la utilización de aguas residuales. Actualmente tienen un gran futuro en su aplicación a la maricultura algal en sistemas de biofiltración.
Inconvenientes del cultivo en tierra
Las densidades de algas deben ajustarse semanalmente requiriendo un buen número de tanques para el desdoble. 
Cultivo en el mar
Selección del sitio de cultivo
 Un buen sitio es simplemente un entorno donde las algas crezcan bien. Con una tasa de crecimiento anual promedio mayor al 4% de su peso por día. Es esencial probar la tasa de crecimiento con líneas de esquejes en parcelas control ubicadas en diferentes lugares. También es necesario garantizar las siguientes características del sitio:
Un buen sitio es simplemente un entorno donde las algas crezcan bien. Con una tasa de crecimiento anual promedio mayor al 4% de su peso por día. Es esencial probar la tasa de crecimiento con líneas de esquejes en parcelas control ubicadas en diferentes lugares. También es necesario garantizar las siguientes características del sitio:
- Corrientes de agua y olas moderadas para aumentar la absorción de nutrientes.
- Luz adecuada más no excesiva.
- Profundidad suficiente de agua. En zonas poco profundas las estacas no deben exponerse durante la marea baja.
- En zonas poco profundas el sustrato debe ser oscuro, con materiales rocosos, de coral o arena gruesa. Deben evitarse los sustratos de arena fina y blanca.
- Presencia mínima de depredadores, microorganismos, epífitos de sedimentos y espuma.
- Rango óptimo de temperatura: 27-30 ºC (dependiendo de la especie).
- Que no se encuentre cerca de la desembocadura de un río. La salinidad debe mantenerse entre 23 y 38 ppm y la turbidez del agua dentro de límites razonables.
Sistemas de cultivo
En general el cultivo en el mar se realiza bajo dos modalidades cultivo de fondo y cultivo suspendido.
Cultivo de fondo
Este sistema de cultivo se asemeja a sistemas utilizados en agricultura donde se siembra directamente al sustrato. Mediante el uso herramientas tales como palas u horquillas. 

Repoblamiento en arena con una especie de Sargassum.
Cultivo suspendido

Sistema de cultivo suspendido o long-line.
En este sistema se utilizan propágulos vegetativos amarrados a cuerdas o redes que luego se convertirán en un alga.
Instalación de cuerdas en cultivo suspendido
Las cuerdas de cultivo suspendido pueden colocarse directamente flotando en la superficie del agua o sumergida, sujetas mediante estacas. 

Cuerdas
Las cuerdas que se utilizan de material sintético como polipropileno pueden ser tan delgadas como de 4 mm en donde van las algas. Mientras que las principales pueden ser de mayor grosor. La distancia entre líneas variará según la especie y otras condiciones. A una distancia entre líneas de 0,8 a 1,0 m se provee un espaciamiento adecuado para las algas tropicales, las cuales generalmente crecen a menor tamaño que las de aguas frías. El largo de cada línea es también variable, evitando siempre que se enreden. Se recomienda de 10 a 50 m de largo dependiendo de las condiciones del agua, viento, oleaje y corrientes.
Anclaje del sistema
Se debe considerar las corrientes u oleaje al que estará sometida la siembra. En aguas tranquilas una línea de 20 a 50 m de algas puede ser retenida por un saco con arena en cada extremo. En caso de aguas más profundas deberán emplearse anclajes de mayor peso. Pueden ser construidos de concreto, barriles plásticos enteros o medios rellenos de concreto con varillas salientes para mejorar el anclaje al fondo. 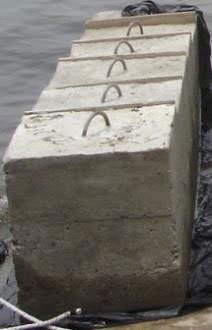
Sistemas de flotación
Estos van desde boyas estándar que se encuentran en el mercado, tanto para pesca como para amarre de embarcaciones. También se reutilizan botellas o “galones” plásticos bien cerrados. En estos últimos casos es conveniente sellar la tapa con pegamento o resina. Preferiblemente durante horas de poco calor para evitar contracción del volumen. 
Siembra o amarre del alga
Para el cultivo en cuerda se pueden emplear las cuerdas con esporofitos juveniles obtenidos en el hatchery. Se amarran a la línea madre o fragmentos vegetativos de algas de 10 cm o más. Otra técnica consiste en insertar en la cuerda o se amarran con un hilo o cordel delgado. Este procedimiento debe hacerse a la sombra. Evitando el estrés de estar fuera del agua y la exposición directa al sol. 
Temperatura de agua
La temperatura del agua de mar es un factor limitante para el crecimiento. Lo ideal es que esté entre 20 ° y 32 ° C. Un cambio repentino de temperatura, incluso si permanece dentro del rango ideal, puede tener un efecto negativo en el crecimiento de las algas.
Exposición prolongada de algas al aire

Salinidad
La salinidad también es un factor limitante en el crecimiento de las algas, particularmente si disminuye rápidamente. Una disminución rápida en la salinidad generalmente ocurre resultado de fuertes lluvias en áreas adyacentes a la descarga de ríos. El agua dulce flota más que el agua salada de mar, por lo que permanece en la superficie lo que puede perjudicar a las algas. Una solución consiste en establecer las líneas al menos 1 metro debajo de la superficie del mar.
Turbidez
Las algas pueden soportar un cierto nivel de turbidez, pero son vulnerables a la alta turbidez causada por material terrígeno. Este puede adherirse al talo e inducir la enfermedad del hielo. Los agricultores necesitan sacudir regularmente sus líneas para eliminar el limo de depósitos de las algas.
Tormentas y Ciclones
Es obvio que las granjas de algas son vulnerables al mal tiempo. Para minimizar su impacto en la granja se recomienda elegir sitios que estén protegidos siempre que sea posible. Adicionalmente es importante monitorear los pronósticos del tiempo. Si el pronóstico es amenazante los agricultores deberían movilizar o cosechar las algas más viejas evitando cualquier pérdida. Posteriormente debe reemplazarse el cultivo con esquejes más pequeños de unos 25 g.
Muestreos de crecimiento
Las líneas de algas deben ser monitoreadas mensualmente para evaluar el desarrollo del cultivo. Para esto se toman muestras de 15 cm en 4 – 5 puntos aleatorios a lo largo de las líneas. Luego se colocan individualmente en bolsa de plástico con cierre. 
Muestreos de calidad de agua
Durante el muestreo se deben medir parámetros ambientales como temperatura, turbidez e intensidad de luz. La temperatura del agua de mar puede ser muestreada con un termómetro simple, pero es preferible que se pueda tomar a diferentes profundidades. La turbidez se estima con un disco de Secchi. Este consiste en un círculo con triángulos blancos y negros al cual se ata una cuerda o tabla graduada. El disco se introduce en el agua midiendo la longitud a la cual ya no se ven los triángulos. 
Mantenimiento del sistema
El mantenimiento consiste en:
- Limpiar los epifitos asociados a las cuerdas.
- Limpiar las algas de sedimentos y tierra.
- Cosechar las estacas con bajo crecimiento.
- Reemplazar las estacas de bajo crecimiento por unas de alto crecimiento.
Los epifitos compiten con las algas por los nutrientes y la energía del sol. Reduciendo asi el crecimiento del cultivo. Adicionalmente se deben tomar en cuenta las siguientes recomendaciones:
- Eliminar otras especies de algas que crecen asociadas al cultivo.
- Reemplazar las plantas perdidas.
- Reparar los sistemas de soporte y eliminar los depredadores bénticos.

Cosecha y transporte de algas
Luego de determinar que los cultivos han crecido lo necesario, lo cual varía según la especie e incluso según las demandas del mercado, se inicia con la cosecha que tiene dos modalidades básicas. Una consiste simplemente en la poda de cada una de las algas. Debe dejarse en las cuerdas cantidad suficiente para garantizar el retoño rápido y saludable de cada una de las plantas. La otra modalidad es remover las cuerdas y transportarlas enteras a la costa, en donde se procede a extraer el material de las algas. El transporte de la cosecha a tierra es una operación de cierta complicación, sobre todo tratándose de cientos de kilos o incluso toneladas de material que debe llevarse cuidadosamente. Para la separación de las algas de las cuerdas se pueden utilizar herramientas mecánicas simples, como una tabla con un hueco por el que se pasa la cuerda con las algas. Estas van siendo separadas dejando las cuerdas limpias para una siguiente siembra. Esta última variante es muy utilizada en cultivos para hidrocoloides. Se separan las plantas de más edad donde se concentran estos compuestos del tejido más tierno. De este último se sacan los propágulos para la siguiente siembra. 
Producciones
Los niveles de producción publicados en macroalgas han sido diversos y su variabilidad depende de los siguientes factores:
- La especie.
- La localidad.
- Tipo de siembra: directa, mediante plántulas obtenidas del laboratorio.
- Tipo de cultivo: de fondo, en suspensión.
- Periodo de tiempo de permanencia en cultivo.
En el caso de Macrocystis pirifera las producciones publicadas van entre 14 Kg m¯¹ y 80 Kg m¯¹.. Estos valores corresponden a cuatro y diez meses de cultivo y van a depender de la técnica usada, latitud y temporalidad.
Manejo poscosecha y almacenamiento de las macroalgas
En el siguiente diagrama se ilustra el proceso general de tratamiento de un producto recién cosechado traído a tierra.
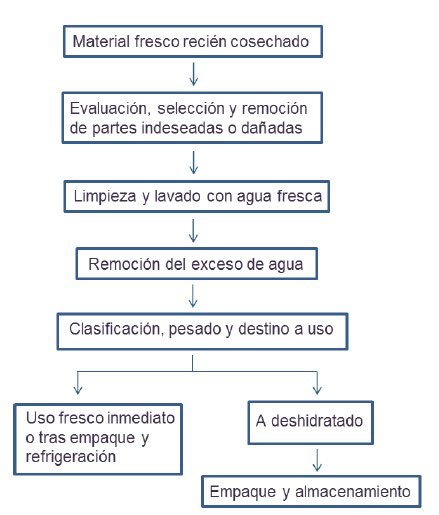
Flujo de procesos a seguir con material recién cosechado.
- El proceso consiste en las siguientes etapas generales:
- Evaluación inicial.
- Depuración primaria removiendo partes indeseadas como rizoides, pedazos podridos otras algas.
- Remoción de animales pequeños como caracoles y cangrejos, entre otros.
- Todo el material debe ser lavado con agua fresca, con la que se remueve la sal superficial y las impurezas menores que hayan quedado.

- Remoción del agua sobrante.
- Clasificar el producto dependiendo del destino de uso que se pretenda.
- Se pasa a uso fresco inmediato o se empaca.
- Almacenar en refrigeración o se procede a deshidratar.
Métodos de deshidratación
Existen varios métodos de deshidratado adecuados para uso como alimento.
- Directo al sol (a) que puede ser adecuado para uso casero.
- En un túnel de plástico para proteger de la lluvia, suciedades, insectos (b). Lo cual puede hacerse también con una gama de otros diseños.
- En un horno (c) cuyo secado se realiza a 50 o 60 °C por 24 horas.

Almacenamiento
Los bultos de algas deben almacenarse en una especie de cobertizo o almacén. Se recomienda no almacenar fardos de algas durante más de 6 meses. Deben mantenerse secos para evitar inicio de fermentación que podría degradar la calidad de la carragenina. 
Comercialización
La mayor parte de los recursos algales, bien sea de praderas naturales u obtenidos mediante cultivos a pequeña escala, son destinados para su comercialización como:
- Productos secos.
- Carragenina.
- Agar-agar.
- Colagar o alginatos.
- Las algas pardas son principalmente destinadas a secado.
Es importante comenzar a identificar posibles puntos de venta desde el principio del cultivo. Esto no es sencillo muchos compradores saben que generalmente solo el 25% de las nuevas empresas de algas tendrán éxito. Como referencia los compradores de algas solo están interesados en productores que proporcionen una biomasa regular y de alta calidad. Con una producción de al menos 1.000 toneladas métricas por año.
Precio de las algas
En general los precios de las macroalgas varían entre las diferentes especies, calidad, país de origen, entre otros. Las fluctuaciones de precio también ocurren dependiendo de la estación y de la oferta y demanda del producto. Cuando los precios son bajos los cultivadores tienden a abandonar sus granjas, disminuyendo la oferta. Lo que mueve los precios hacia arriba otra vez, debido a la demanda. Durante la última década los precios de las algas han rondado los 250 dólares por tonelada métrica. Existe cierta presión a la baja sobre los precios de especies templadas debido al aumento de la producción en China.

Valor promedio global (1000 USD / tonelada métrica de peso seco) de algas cultivadas. Fuente: FAO 2014.
De los reportados para el año 2012:
- Saccharina, Porphyra (1862 $/TM), Undaria (453 $/TM) se utilizan principalmente para consumo humano directo.
- Kappaphycus, Eucheuma y Gracillaria se usan en la producción de productos de consumo lo cual ha mantenido los precios elevados a nivel global.
- La producción de Kappaphycus (177 $/TM) y Eucheuma (208 $ /TM) es más relevante para los países tropicales en desarrollo.
Costos de producción
Los costos de producción dependen de tres factores:
- Activos fijos.
- Costos de operación.
- Costos de depreciación.

Los costos de operación de una granja de 0,25 ha representa el 75 por ciento de los costos de producción conformado por:
- Costo de los esquejes.
- Mano de obra (representa aproximadamente 72 por ciento de los costos de producción).
- Algunos gastos misceláneos.
Los activos fijos, insumos y materiales para la construcción del sistema de soporte de la granja, representan 23 por ciento.
La depreciación un máximo de 2,0 por ciento.
La tasa de retorno (utilidad sobre la inversión) depende de la productividad de las granjas y varía de acuerdo con la tasa de crecimiento de las plantas. Las tasas diarias de crecimiento aceptable de las plantas no deben ser inferiores al 3,0 ó 4,0 por ciento.
Presupuesto sistema de producción para algas rojas
La siguiente tabla ilustra un presupuesto estimado de un sistema de producción para algas rojas cultivadas en zonas cercana a la costa (~ 1 km) en un ambiente tropical.
| Descripción | Numero | Precio unitario | Total por año ($) | Notas |
| Líneas de semillas | 1874 | 0,83 | 1555 | |
| Long-line instalado | 15 | 172 | 2580 | 1000 m de línea de semilla por long-line |
| Operación | 15 | 170 | 25506685 | |
| Retorno | 14,4 | 900 | 12960 | 120 Ton de peso seco |
| Beneficio neto (por unidad) | 6275 | |||
| Costos de producción (por kg) | 0,46 |
Gastos de capital y operación de un módulo de producción de 150 x 150 m de algas marinas Euchema spp. (para carragenina) en un país tropical en desarrollo. Fuente: Valderrama y col. (2015).
Principales enemigos de las macroalgas
Depredadores o competidores
Las mayores pérdidas en el cultivo de algas son debidas al pastoreo de peces herbívoros, aunque normalmente esto es solo un problema estacional.
Estos peces generalmente se refugian alrededor de rocas y corales. Por lo tanto, la única mitigación disponible para esto es evitar ubicar parcelas de algas cerca de tales características.
El pastoreo representa una pérdida de la producción menor en parcelas de algas maduras, pero los viveros pueden ser más vulnerables y sufrir mayores pérdidas.

Enfermedades en macroalgas
Se han descrito una gran variedad de enfermedades infecciosas y no infecciosas en macroalgas marinas.
En las primeras (transmisibles) un agente biológico es el responsable de la enfermedad como virus, bacterias, hongos, nemátodos, y algas parásitas.
Mientras que las segundas (no transmisibles) están causadas por factores abióticos. Abarcan todo tipo de desórdenes originados por cambios ambientales y agentes contaminantes.
A continuación un resumen de algunas de las enfermedades más importantes en cultivo:
Enfermedades por bacterias
| Enfermedad | Huésped | Agente causal | Síntomas | Tratamientos |
| Enfermedad del hielo | Kappaphycus y Eucheuma | Bacterias | Blanqueamiento del talo en las puntas de la planta y cerca del sitio de sujeción a cuerdas de cultivo. | Transferir a zonas donde el agua esté fría y haya buena circulación de la misma. |
| Enfermedad de la fronda retorcida | Laminaria japonica | Organismos tipo Micoplasma o ambiental | Estipes engrosados, hinchados y huecos.Frondas retorcidas o con forma espiral. Algunos estipes se dividen en dos partes juntando la lámina al disco. | Reducir la intensidad de la luz ajustando la altura de las cuerdas de cultivo. |
| Enfermedades de Malformación | Laminariales | Bacterias gram positiva | Malformación de varias etapas de la vida, incluidos gametofitos, esporofitosy huevos dentro del oogonio, que se cree que son causados por saprofitos bacterias y malas prácticas de cultivo. | Evitar el uso de laminarias reproductoras enfermas.Esterilizar el sistema de circulación de aguas. Limpiar substratos y tanques de cultivo de plántulas. Cambiar toda el agua de mar. Bajar la temperatura del agua circulante <10 °C. Reducir la densidad de siembra. |
| Enfermedad del desprendimiento de las plántulas | Undaria pinnatifidaPorphyra | PseudomonasVibrio | Las plántulas se desprenden de las cuerdas de cultivo.Los estipes se ponen blandos y se destiñen. Los discos de fijación se ponen duros. Quebradizos y se debilitan. Putrefacción del estipe y puntas de la lámina. | Reducir la iluminación excesiva.Tratar con antibióticos en los tanques de cultivo. |
Enfermedades por hongos
| Enfermedad | Huésped | Agente causal | Síntomas | Tratamientos |
| Enfermedad de la podredumbre roja | Porphyra | Pythium,Alternaria sp. | Pequeñas manchas rojas en las hojas infectadas. La lámina cambia de color a violeta.y aparecen numerosos agujeros antes de que la lámina se desintegre por completo. | Lavado del talo en un ácido de pH 2.0 durante 5 minutos. |
| Enfermedad de la mancha blanca | Porphyra | Phoma sp. | Manchas blancas en el borde del talo, que gradualmente se expande y forma lesiones. | No hay tratamiento efectivo disponible. |
Enfermedades por virus
| Enfermedad | Huésped | Agente causal | Síntomas | Tratamientos |
| Enfermedad de manchas verdes | Pyropia | virus | Cadenas verdes de células muertas fusionadas se desarrollanheridas del tallo, seguidas de hileras de células rosadas alrededor y verdes en el centro de la lesión en desarrollo. | No hay tratamiento efectivo disponible. |
Enfermedad por organismos epifitos
| Enfermedad | Huésped | Agente causal | Síntomas | Tratamientos |
| Algas filamentosas epifitas | Kappahphycus y Eucheuma | Melanothamnus sp.Neosiphonia apiculate Cladophora sp. | Pequeñas manchas negras visibles en la corteza del huésped, seguidas de la aparición de “piel de gallina” a medida que madura la epífita.Al final de infección, se dejan hoyos oscuros en la superficie cortical, y el huésped está infectado por bacterias oportunistas. | Sumergir un metro debajo de la superficie en zonas con corrientes moderadas.La exposición a condiciones ácidas puede ser parcialmente efectiva. |
Enfermedad por condiciones ambientales
| Enfermedad | Huésped | Agente causal | Síntomas | Tratamientos |
| Enfermedad de la putrefacción verde | Laminarias | Temperaturas no óptimas.Niveles de amonio elevado. | La parte apical de las frondas se vuelve verdosa y se pone blanda.Los síntomas se extienden gradualmente a la parte más baja de las frondas. Finalmente resulta en decaimiento y muerte de la planta entera. | Levantar las cuerdas de cultivo; invertir periódicamente las cuerdas de cultivo. |
| Enfermedad de la putrefacción blanca | Laminarias | Temperaturas no óptimas.Niveles de amonio elevado. | Las láminas se descoloran desde café a amarillento y finalmente a blanco.La enfermedad se extiende desde la parte apical a la parte más baja. Eventualmente la fronda completa se descompone y cae desde la cuerda de cultivo. | Aplicar fertilizantes basados en nitrógeno sobre el área del cultivo marino.Bajar las cuerdas de cultivo para disminuir la iluminación. |
| Enfermedad de la ampolla | Laminarias | Temperaturas no óptimas.Niveles de amonio elevado. | Se forman ampollas sobre las frondas, seguido por la descomposición. | Bajar las cuerdas de cultivo por debajo de la masa de agua dulce (que tiende a estar cerca de la superficie). |

Enfermedad del hielo.

Infección por Bacterias (A) y hongos (B).

Epifitas en Gracilaria.
Futuro del rubro de las macroalgas
Las tecnologías de acuicultura de algas se han desarrollado dramáticamente en las últimas décadas, pero todavía hay desafíos que superar.
El desarrollo de nuevas cepas mediante herramientas de mejoramiento avanzadas es el desafío más urgente. Las cepas superiores permitirán a los productores expandir las temporadas de cultivo y mejorar la producción.
Teniendo en cuenta los desafíos climáticos mundiales puede ser necesario el desarrollo de cepas termo-tolerantes. También deben desarrollarse las cepas con resistencia a enfermedades, crecimiento rápido, alta concentración de moléculas deseadas y la reducción de organismos incrustantes.
El desarrollo de tecnologías de cultivo más robustas y rentables es muy importante. Con la acuicultura en alta mar se requerirán nuevos diseños y enfoques para el cultivo de macroalgas. Incluyendo el desarrollo de cepas, la cosecha, el transporte y el procesamiento.

Situación en América Latina
Con respecto a Latinoamérica (LA), la industria de la acuicultura de macroalgas aún está en la infancia. Su desarrollo requiere adoptar varias estrategias biológicas, políticas y tecnológicas para lograr una producción sostenible y rentable de algas.
Los países que conforman esta vasta área geográfica cuentan con muchos tipos de ecosistemas costeros. Incluyen diversas especies de algas con potencial para el desarrollo del cultivo algal.
Por otra parte, esta actividad tiene el potencial de mejorar los medios de vida de muchas comunidades costeras al convertirse en una fuente alternativa de ingresos.
Además, la actividad puede beneficiar a otras industrias. Liberando las presiones existentes de cosecha sobre bancos naturales que han llevado a la sobreexplotación de los mismos.
Sin embargo, para lograr el desarrollo sostenible del sector en LA se necesita un esfuerzo amplio en todos los países en diferentes niveles. En este sentido se requiere tomar las siguientes acciones:
- Abordar el desarrollo del mercado y mejoramiento de cepas.
- Planificación espacial marina.
- Políticas para promover la domesticación de especies nativas.
- Mejorar las técnicas ya establecidas en especies introducidas.
Algunas formas de consumo de macroalgas
 |  |
| Kombu (Laminareaceas)Para la obtención de caldos | Wakame (Undaria pinnatifida)Uso en sopas y ensaladas |
 |  |
| Nori (Porphyra)Como acompañante del arroz, en sushi y en cocidos | Aosa (Ulva)Alga de uso similar al wakame, en sopas y ensaladas |
 |  |
| Mozuku (Cladosiphon okamuranus)Alga de consumo directo en forma de ensalada o encurtido en vinagre/sal. | Aji nori (Porphyra)Alga nori seco saborizado con sal y aceite de sésamo. |
 |  |
| Galletas de algas | Mermelada de algas cochayuyo |
Compiladora.
Msc. en Ciencias Marinas. Trinidad Urbano
Referencias Consultadas
Alemán, A.; Robledo, D.; Hayashi, L. 2019. Development of seaweed cultivation in Latin America: current trends and future prospects, Phycologia, 58(5): 462-471. https://doi.org/10.1080/00318884.2019.1640996 Ávila, M.; Merino, P.; Guissen, K.; Piel, M. 2010. Manual de cultivo de macroalgas pardas: Desde el laboratorio al océano. Fondo de Innovación para la Competitividad Regional (FICR) – Gobierno Regional de Tarapacá. Universidad Arturo Prat. Iquique Chile. 36 pp. Commercial Seaweed Market – Growth, Trends, and Forecast (2020 – 2025) https://www.mordorintelligence.com/industry-reports/commercial-seaweed-market. Consultado el 16/04/2020 De san, M. 2012. The Farming of Seaweeds. REPORT/RAPPORT: SF/2012/28. SmartFish Programme Indian Ocean Commission, 26 pp. Dreckmann, K.; Sentíes, A.; Núñez, M. Manual de prácticas de laboratorio Biología de algas. 2013. Ed. Universidad Autónoma Metropolitana Unidad Iztapalapa, México, 87 pp. FAO. 2018. El estado mundial de la pesca y la acuicultura 2018. Cumplir los objetivos de desarrollo sostenible. Roma. Licencia: CC BY-NC-SA 3.0 IGO. FAO (2014). The State of World Fisheries and Aquaculture. Food and Agriculture Organization of the United Nations, Rome. FAO. 2005. Fisheries and Aquaculture Department. Porphyra spp. Cultured Aquatic Species Information Programme. Rome, Italy. URL: http://www.fao.org/fishery/culturedspecies/Porphyra_spp/en tcNA002B FAO. 2006. Fisheries and Aquaculture Department. Gracilaria spp. Cultured Aquatic Species Information Programme. Rome, Italy. Ferdouse, F.; Yang, Z.; Lovstad Holdt, S.; Murúa, P; Smith, R. 2018. The global status of seaweed production, trade and utilization. Globefish Research Programme, FAO, Rome, Italy. 124: 115 pp. MacArtain, P.; Gill, C.; Brooks, M.; Campbell, R.; Rowland, I. 2007. Nutritional value of edible seaweeds. Nutrition Reviews 65(12): 535- 543. Mooney-McAuley, K.; Edwards, M.; Champenois, J.; Gorman, E. 2016. Best Practice Guidelines for Seaweed Cultivation and Analysis, Public Output report of the EnAlgae project, Swansea, 36pp. Available online at www.enalgae.eu. Polat, S; Ozogul, Y. 2013. Seasonal proximate and fatty acid variations of some seaweeds from the northeastern Miditerranean coast. Oceanología 55(2): 375-391. Radulovich, R.; Umanzor, S.; Cabrera, R. 2013. Algas Tropicales: Cultivo y uso como alimento. Ed. Universidad de Costa Rica, San José. 52 pp. Disponible online en http://www.maricultura.net. Redmond, S.; Green, L.; Yarish, C.; Kim, J.; Neefus. C. 2014. New England Seaweed Culture Handbook-Nursery Systems. Connecticut Sea Grant CTSG‐14‐01. 92 pp. http://seagrant.uconn.edu/publications/aquaculture/handbook.pdf. Saavedra, S.; Henríquez, L.; Leal, P.; Galleguillos, F.; Cook, S.; Cárcamo, F. 2019. Cultivo de Macroalgas: Diversificación de la Acuicultura de Pequeña Escala en Chile. Convenio de Desempeño, Subsecretaría de Economía y Empresas de Menor Tamaño. Instituto de Fomento Pesquero. 106 pp. Sierra-Vélez, L.; Álvarez-León, R. 2009. Comparación bromatológica de las algas nativas (Gracilariopsis tenuifrons, Sargassum filipendula) y exóticas (Kappaphycus alvarezii) del Caribe Colombiano. Bol. Cient. Mus. Hist. Nat. Univ. Caldas, 13 (2). Ugarte, R; Santelices, B. 1992. Experimental tank cultivation of Gracilaria chilensis in central Chile. Aquaculture, 101: 7-16. Valderrama, D.; Cai, J.; Hishamunda, N.; Reidler, N.; Neish, I. C.; Hurtado, A. Q.; Msuya, F. E.; Krishnan, M.; Narayanakumar, R.; Kronen, M.; Robledo, D.; Gasca-Leyva, E.; Fraga, J., 2015. The economics of Kappaphycus seaweed cultivation in developing countries: a comparative analysis of farming systems. Aquaculture Economics and Management 19, 251–277. Vilma Quitral, R.; Carla Morales, G.; Marcela Sepúlveda, L.; Marco Schwartz, M. 2012. Propiedades nutritivas y saludables de algas marinas y su potencialidad como ingrediente funcional. Rev. Chil. Nutr., 39 (4). Ward, G.; Faisan Jr, J.; Cottier-Cook, E.; Gachon, C.; Hurtado, A.; Lim, P.; Matoju, I.; Msuya, F.; Bass, D.; Brodie, J. 2019. A review of reported seaweed diseases and pests in aquaculture in Asia. J. World Aquacult. Soc. 1–14. https://doi.org/10.1111/jwas.12649
Te invitamos a que te suscribas a nuestro canal de YouTube donde podrás ver más sobre el cultivo de las macroalgas, en un micro de 2 minutos sobre sus características y usos.
NOTA: Agropedia es una herramienta de Agrotendencia TV para la producción y difusión de conocimiento técnico-agrícola especializado enfocado a optimizar el uso de los recursos y mejorar significativamente el manejo de los sistemas de producción en América Latina. Puedes acceder a la información más actualizada sobre la agricultura en el mundo a traves de nuestro portal web: Agrotendencia.tv
